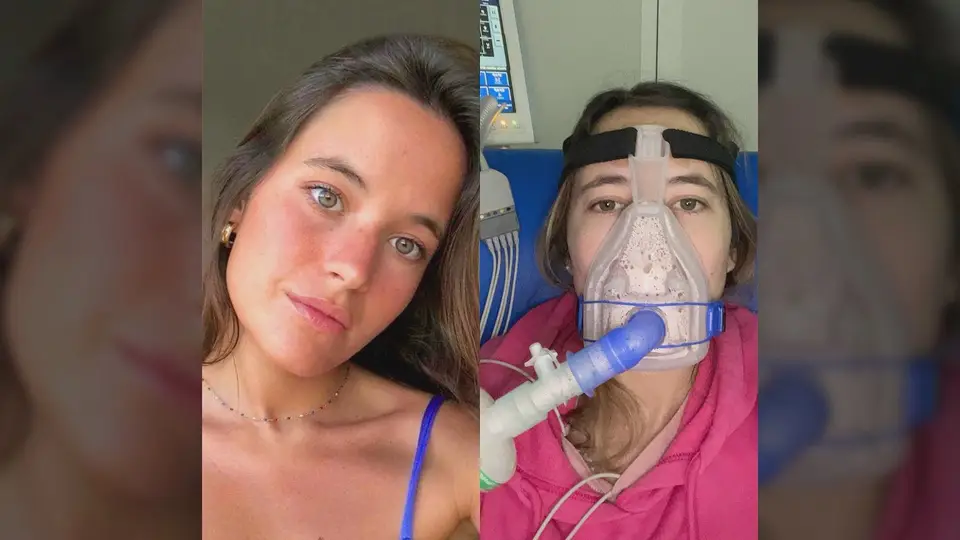
O apelo viral de Constança Braddell deu um rosto à fibrose quística: em março, a jovem de 24 anos suplicava por um medicamento inovador que ainda não tinha sido aprovado em Portugal. Quatro meses depois da publicação nas redes sociais, o Kaftrio continua à espera de aprovação do Infarmed para chegar aos hospitais e à generalidade dos doentes com fibrose quística.
Atualmente, o Kaftrio apenas pode ser prescrito ao abrigo do Plano de Acesso Precoce (PAP). É para isso necessária uma autorização excecional, concedida quando não existem alternativas terapêuticas e em situações que o doente corra risco imediato de vida ou de sofrer complicações graves.
Por estar num estado muito avançado da doença, Constança foi aceite na lista de acesso precoce e teve acesso ao medicamento. Segundo o Infarmed, há atualmente 27 pacientes a quem o Kaftrio foi prescrito mediante a autorização excecionais (AUE). Fora deste grupo ficam os pacientes que, tendo a doença, não correm risco imediato de vida.
O medicamento em questão faz parte de uma família de fármacos modeladores e atua ao nível da proteína defeituosa, tornando-a mais funcional. Desta forma, os pacientes com fibrose quística poderão ter uma redução dos sintomas, travando a degradação pulmonar que é característica da doença.
Um dos sintomas de fibrose quística é o aumento da espessura das mucosas, o que causa infeções e lesões nos pulmões. À medida que a doença progride, há uma sucessiva degradação do órgão respiratório e muitos dos pacientes têm de ser sujeitos a um transplante pulmonar para sobreviver.
Quanto mais cedo se iniciar o tratamento, menores são as lesões nos pulmões. É por essa razão que a Associação Portuguesa de Fibrose Quística (APFQ) e a Associação Nacional de Fibrose Quística (ANFQ) têm vindo a pedir que o Kaftrio seja aprovado urgentemente.
Ambas as organizações têm acompanhado de perto a evolução do processo, mas continuam sem ver luz verde. À SIC Notícias, o Infarmed garante que “o processo encontra-se em fase final de conclusão”, não avançando qualquer data para a conclusão.
O passo a seguir
Joana Roque, vice-presidente da ANFQ, explica que a aprovação do regulador ainda não é o último passo: “Depois desta avaliação pelo Infarmed, há um parecer que terá de ser assinado pelo secretário de Estado da Saúde. Até ao momento não temos nenhuma informação de que já tenha seguido para o secretário de Estado da Saúde”.
A assinatura do parecer poderá levar dias ou até meses. No caso dos medicamentos anteriores – o Orkambi e o Kalydeco – o secretário de Estado demorou cerca de três meses a assinar a autorização, lembram ambos os responsáveis. Tanto a ANFQ como a APFQ apelam para que, desta vez, o processo seja rápido.
“Só depois do secretário de Estado assinar é que os hospitais poderão começar a fornecer os medicamentos aos doentes” acrescenta Herculano Rocha, presidente da APFQ. “Vamos pedir a aprovação imediata porque não podemos esperar mais tempo.”
Tempo é o principal fator nesta corrida. O medicamento está atualmente em aprovação para maiores de 12 anos, podendo estagnar a evolução da patologia em fases muito precoces. Desta forma, não só os doentes poderão ter uma melhor qualidade de vida, como a própria esperança média de vida aumenta. Mas tal só acontecerá depois do medicamento ser aprovado.
“O que é preciso é que a medicação seja iniciada o mais rápido possível para que possamos ter doentes com qualidade de vida. Se nós começarmos o medicamento cedo e evitarmos as infeções, em vez de ter, por exemplo, um declínio da função pulmonar de 20 ou 30% num ano, podemos passar a ter um declínio só de 5%”, afirma Herculano Rocha, lembrando as “melhorias espetaculares” que estão a ser identificadas nos doentes que recebem o medicamento ao abrigo do PAP.
Críticas à avaliação do Kaftrio
O presidente da APFQ lança várias críticas ao que considera ser uma “lentidão exasperante” do Infarmed para aprovar o medicamento. Herculano Rocha considera que a processo em curso é redundante, pois a avaliação farmacoterapêutica já foi também feita pela FDA, o regulador norte-americano, e pela Agência Europeia do Medicamento (EMA, na sigla inglesa). O médico lembra que o trabalho desenvolvido por ambos os reguladores internacionais “merece toda a credibilidade”.
À SIC Notícias, o Infarmed explica que a avaliação realizada pela Comissão de Avaliação de Tecnologias da Saúde “é essencial de forma a garantir as melhores condições de aquisição dos medicamentos para os hospitais do Serviço Nacional de Saúde (SNS) e, consequentemente, acesso de todos os cidadãos quer às terapêuticas inovadoras, quer aos demais cuidados que necessitem no contexto do SNS”. Avança ainda que “esta avaliação não acontece só em Portugal como nos restantes países europeus”.
Por outro lado, Joana Roque, reconhece que o processo de avaliação do Kaftrio foi mais célere do que dos anteriores fármacos modeladores – o Orkambi e o Kalydeco – que demoraram vários anos até chegarem aos hospitais portugueses.
“Os processos têm demorado sempre anos e anos. E realmente esta é a primeira vez que temos uma resposta muito mais rápida. A Constança conseguiu dar uma cara e uma visibilidade à doença que, até agora, nunca tínhamos conseguido. E a verdade é que o processo mexeu-se muito mais rápido comparativamente com os anteriores”, diz a vice-presidente da ANFQ, sublinhando, porém, que não é possível estabelecer uma relação causa-efeito.
O apelo de Constança chamou a atenção para a doença genética mais frequente entre os caucasianos: a fibrose quística tem uma incidência média de 1/2500 na Europa e de 1/7000 em Portugal. Há perto de 380 doentes diagnosticados no país.
Apesar de existirem já dois medicamentos aprovados para o tratamento da fibrose quística em Portugal, o Kaftrio tem uma abrangência maior no tratamento da doença. Este fármaco atua tanto nos doentes que tenham duas mutações F508 – a mutação predominante no país – como naqueles que têm apenas uma mutação F508 e outra de função secundária.
Veja mais:
- “Como é que vou lidar se a minha filha estiver morta aos 20 anos?”
- Pneumologista diz que número de doentes com fibrose quística com fármacos inovadores já é significativo
- O caso de Constança Braddell, a jovem que emocionou o país
- Morreu Constança Braddell, a jovem que sofria de fibrose quística
- Portugal tem agora o primeiro registo de doentes com fibrose pulmonar
- Fibrose quística. Grupo de doentes elegíveis começa a tomar o Kaftrio esta semana
- "Não quero morrer". Constança sofre de fibrose quística e precisa de um medicamento que não há em Portugal